Влияние характеристик ковалентной связи на свойства соединений. Ковалентная связь. Ее свойства. Вопросы для самоконтроля
Энергия связи – мера прочности химической связи, количество энергии, выделяющееся при образовании химической связи.
Любая химическая связь образуется с выделением энергии, для ее разрыва требуется затратить энергию, равную энергии связи.
Длина химической связи
– это расстояние между центрами ядер атомов в молекуле, когда силы притяжения между атомами уравновешены силами отталкивания и энергия системы минимальна.
Физическое состояние: ковалентные соединения могут существовать во всех трех состояниях, т.е. твердом, жидком и газообразном. В ковалентных соединениях составляющие частицы представляют собой атомы, которые связаны друг с другом в виде сети. Электрическая проводимость: ковалентные соединения являются плохими проводниками электричества, поскольку в них нет ионов, которые могут перемещать или проводить электричество. Теплота испарения: теплота испарения ковалентных соединений низка. Давление паров: ковалентные соединения имеют очень давление пара. Ковалентные соединения обычно нерастворимы в воде и в других полярных растворителях. Однако они растворимы в неполярных растворителях.
- Кристаллическая структура.
- Поэтому ковалентные соединения имеют низкую температуру плавления и кипения.
Кратность (порядок) связи – это число общих электронных пар, участвующих в образовании связи.
Насыщаемость − способность атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей.
Направленность связи показывает, в каком направлении смещается электронная плотность связи. Обычно это происходит от менее электроотрицательного атома к более электроотрицательному.Это параметр, определяющий пространственную структуру молекул, их геометрию, форму.
Например, молекула воды представляет собой химическую связь двух атомов водорода и одного атома кислорода. Существует два типа связей: ковалентные и ионные. Это очень разные типы соединений с различными атрибутами. Химические связи между двумя неметаллами являются ковалентными связями. Их электроотрицательные свойства схожи, и они разделяют пары электронов между атомами. Вы можете определить, является ли соединение ковалентным по своему состоянию при комнатной температуре и стандартном давлении; если это жидкость или газ, она будет ковалентной.
Полярность химических связей - характеристика, показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах. В качестве количественной меры полярности связи используются так называемые эффективные заряды на атомах: Н +δ –Cl −δ . Полярность связи может быть выражена через ее дипольный момент μ св :
Они имеют низкие температуры кипения и плавления и слегка полярны. Пока разница в электроотрицательности атомов меньше 7, связь между ними будет ковалентной. Энергия выделяется при образовании ковалентной связи, поэтому соединение становится более стабильным по мере создания большего количества ковалентных связей.
Ионные соединения встречаются между металлом и неметаллами. Атомы в ионном соединении имеют разницу в электроотрицательности больше 7, что означает, что один из атомов сможет привлечь внешний электрон другого атома. Они твердые при стандартных давлениях и температуре, и они имеют высокую температуру кипения и плавления. Из-за большой разницы в электроотрицательности ионные соединения имеют высокую полярность.
· Неполярная ковалентная связь возникает в том случае, если частица образуется атомами с одинаковыми электроотрицательностями (молекулы состоят из атомов одного вида). В этом случае электронная плотность расположена симметрично между атомами: O 2 , Cl 2 , N 2 .
· Полярная ковалентная связь возникает в том случае, если частица образована атомами с различными электроотрицательностями (молекулы состоят из различных атомов). В этом случае электронная плотность смещена в сторону одного из атомов: НСl, Н 2 О, NO .
Неспецифические виды связи
Многие органические соединения имеют ковалентные связи. Это связано с тем, что они представляют собой связи между углеродом и водородом, такие как метан с атомом углерода и 4 атомами водорода, ни один из которых не является металлом. Ковалентные связи также могут существовать исключительно между двумя атомами одного и того же элемента, такими как газообразный кислород, газообразный азот или хлор. Эти соединения требуют много энергии, чтобы разделиться. Рассматривая периодическую таблицу элементов, любая связь, образованная между неметаллической группой и галогеновой группой, будет ковалентной.
Полярность молекулы определяется разностью электроотрицательностей атомов, образующих двухцентровую связь, геометрией молекулы, а также наличием неподеленных электронных пар, так как часть электронной плотности в молекуле может быть локализована не в направлении связей. Полярность молекулы выражается через ее дипольный момент, который равен векторной сумме всех дипольных моментов связей молекулы .
Настольная соль или хлорид натрия является общеизвестным ионным соединением. Это не требует большой энергии для разрыва ионной связи, о чем свидетельствует способность хлорида натрия легко растворяться в воде. Все атомы стремятся появиться как благородный газ, т.е. хотят взять, дать или поделиться электроном или электронами, чтобы его внешняя электронная оболочка была полностью заполнена. Если у магния было два меньше электронов в своей внешней оболочке, и если бы у кислорода было еще два, то оба они имели бы свои внешние оболочки, поэтому они объединялись для образования стабильного соединения оксида магния.
Поляризуемость связи – выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер. По поляризуемости π-связь значительно превосходит σ-связь, так как максимум электронной плотности π-связи располагается дальше от связываемых ядер.
Хлорид калия, оксид кальция и оксид железа - все примеры соединений с ионными связями. Общая химия охватывает основные темы и терминологию химии и ее подрайонов. Его также можно понимать как введение в эту тему и оно должно содержать основные понятия и принципы.
Что будем делать с полученным материалом
В области общей химии включают такие темы, как атомная структура, структура и значение периодической таблицы, теории различных химических связей, окислительно-восстановительные реакции или кислотно-основные теории. Основное понимание химии включает знание теоретической структуры атомов и их результирующих свойств. Как правило, атом состоит из положительно заряженного ядра и отрицательно заряженных частиц, которые расположены в определенных областях вокруг ядра. Ядро состоит из положительно заряженных протонов и нейтрально заряженных нейтронов и вращается вокруг отрицательно заряженных электронов.
Теория гибридизации
Гибридизация – это усреднение АО центрального атома по форме и энергии перед химическим взаимодействием, что приводит к образованию гибридных орбиталей, направленных в сторону образующейся связи. Число гибридных АО равно числу участвующих в гибридизации исходных АО.
sp 3 -гибридизация : одна s + три р ® четыре sp 3 .
Теории о конкретной структуре атомов постоянно меняются и уточняются на протяжении десятилетий. Начиная с модели по Резерфорду, которая видит отрицательно заряженные частицы на определенных круговых орбитах вокруг положительно заряженного ядра. Нильс Бор развил эту модель дальше и постулировал различные, энергетически разные и определенные пути, по которым электроны могут перемещаться вокруг ядра. С помощью этой модели можно было бы объяснить спектральные линии атома водорода, что ранее невозможно было с помощью теории Резерфорда.
Очень обширная модель была разработана де Бройлем, Гейзенбергом и Шрёдингером, которая включает принцип неопределенности. Вместе с дальнейшими расчетами это приводит к орбиталям вокруг атомного ядра, в которых находятся электроны с определенными вероятностями.
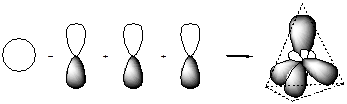
Оси sp 3 -гибридных орбиталей направлены к вершинам правильного тетраэдра, и валентный угол (угол между осями орбиталей) соответствует такому пространственному их расположению и составляет 109°28¢.
Чтобы упорядочить элементы по своим свойствам и их ядерному заряду, Дмитрий Менделеев разработал табличную схему, которая сегодня называется Периодической таблицей элементов. Элементы расположены в порядке возрастания в соответствии с их порядковым номером в основных группах и периодах. Атомное число соответствует числу протонов в ядре соответствующего атома и, следовательно, числу электронов соответствующего элемента.
Существует семь периодов и семь оболочек, образующих горизонтальные линии периодической таблицы. Оболочки - это область вокруг атомного ядра, в которой расположены электроны, и которая определяет химические свойства элемента. Эти оболочки заполнены электронами по определенной схеме, что является следствием теорий орбиталей.
sp 2 – гибридизация : одна s + две р ® три sp 2 .
Оси sp 2 -гибридных орбиталей лежат в одной плоскости и направлены под углом 120° друг к другу.
sp-гибридизация: одна s + одна р ® две sp.
III.Свойства ковалентной связи
В вертикальных колонках представлены 18 групп, в которых выделяются восемь основных групп и десять подгрупп. Группа объединяет элементы со сходными свойствами и одинаковое количество валентных электронов. Валансные электроны - это те электроны, которые находятся в самой внешней оболочке и участвуют в образовании связей с другими атомами.
Из-за различных свойств атомов существуют также различные химические связи. В дополнение к атомному номеру и атомной массе элементам в периодической таблице также назначается электроотрицательность. Эта величина эмпирически указывает на способность атома привлекать электроны при образовании связи. Различные электроотрицательности приводят к различным типам химических связей, которые атомы могут вступать друг в друга. Различают неполярные ковалентные и полярные ковалентные атомные связи, металлические связи и ионные связи.
Оси sp 2 -гибридных орбиталей находятся под углом 180°, то есть лежат на одной прямой. Это ещё менее вытянутые орбитали, чем sp 2 - гибридные.
Если на валентных подуровнях атома часть орбиталей полностью заполнена, эти АО тоже участвуют в гибридизации. Так гибридизуются валентные орбитали атома азота в аммиаке и атома кислорода в воде.
Ионные связи характеризуются большой разницей между значениями электроотрицательности и состоят из положительно заряженных катионов и отрицательно заряженных анионов. Как правило, образуются кристаллические структуры, в которых ионы расположены в зависимости от их заряда и их ионного радиуса.
Атомные связи или даже ковалентные связи обычно возникают между атомами с малой или никакой разницей в электроотрицательности. Здесь валентные электроны разных атомов ответственны за образование связи. Если электронная пара образована одним валентным электроном двух атомов, между этими двумя атомами образуется одинарная связь. Помимо двух одинаковых атомов, эта связь всегда частично поляризована, поскольку один из связующих партнеров всегда имеет более высокую электроотрицательность.
Каждому виду гибридизации АО соответствует определенная геометрическая форма молекулы:
| Вид гибридизации | Число связей | Валент ный угол | Конфигурация орбиталей | Примеры |
| Sp | АВ 2 | 180 0 | линейная | H–Be–H, |
| sp 2 | АВ 3 | 120 o | плоская треугольная | BCl 3 ; |
| sp 3 | а) АВ 4 ; б) АВ 3 ; в) АВ 2 . | а)109,5 o б)107,5 0 в) 104,5 0 | тетраэдрическая | а) CH 4 ; б) NH 3 ; в) Н 2 О. |
| sp 2 d | 90 o | плоская квадратная | 2– , 2– | |
| sp 3 d | АВ 5 | α=90 o ; β = 120 o | тригонально- бипирамидальная | PCl 5 |
| sp 3 d 2 | АВ 6 | 90 o | октаэдрическая | 3– , SF 6 |
Вопросы для самоконтроля
Металлические связи несколько отличаются от других типов химических связей, так как здесь положительно заряженные атомные оболочки также расположены в решетке. С другой стороны, электроны делокализуются по всей решетке из-за слабого притяжения ядра. Это приводит к типичным свойствам металлов, таким как электрическая и теплопроводность, деформируемость и непрозрачность по сравнению с видимым светом.
Клеи работают по двум основным направлениям, объединяющим два элемента: клеи часто также работают с химическими связями. Многие клеи также полагаются на физические соединения. Клеи имеют широкий спектр применений. В качестве конечного использования мы знаем, что клеи, используемые на столе, держат бумагу вместе или склеивают эту клею мебель вместе. Клеи также используются в промышленности и объединяют целые дома. Многие продукты теперь склеены, а не скручены, что особенно характерно для современных смартфонов.
1. Что такое химическая связь? Какие типы химической связи Вы знаете?
2. Метод валентных связей. Основные положения метода.
3. Как образуется ковалентная химическая связь? Какие способы её образования Вы знаете? Приведите соответствующие схемы и примеры.
4. Какие атомы или ионы называют донорами и акцепторами электронных пар? Приведите примеры.
Наклейки также используют клейкие материалы, такие как наклейка для защиты печати, которая позволяет печатать печать на разных отверстиях, чтобы гарантировать, что никто другой не заглянул туда. Еще одно приложение, которое все знают, - это так называемая заметка. Изобретение липкой ноты было скорее совпадающим изобретением. Когда химик снова разработал неисправный клей, он обнаружил, что может использовать неудачную попытку, идеально подходящую для этикеток для маркировки в лаборатории, которую можно было бы вычесть без остатков.
Это стало началом всемирной истории успеха клейкой этикетки, которую мы находим сегодня в каждом офисе. Большинство пластмасс состоят из длинных, относительно гладких цепей молекул, которые могут скользить друг мимо друга. Когда прикладывается тепло, движение цепей увеличивается, цепи теряют сцепление, а пластика смягчается и, наконец, расплавляется. Из-за такого поведения при нагревании такие пластмассы называются термопластами.
5. Валентность. Максимальная валентность. Валентно-насыщенное и валентно-ненасыщенное состояние атома (на примере элементов II периода).
6. Какими свойствами обладает ковалентная связь?
7. Направленность химической связи. Влияние направленности связи на пространственную конфигурацию молекул типа АА, АВ, А 2 В, А 3 В. Насыщаемость, кратность связи длина и энергия связи.
Итак, что вы можете сделать, если хотите сделать пластик, который не тает при нагревании? Вы должны каким-то образом удерживать цепи молекул на месте, чтобы они не проскальзывали мимо и мимо друг друга, и это именно то, что происходит в процессе сшивания. В принципе, это можно сравнить с рыболовной сетью, поскольку подразумевается термин «зацепление»: куча сыпучих нитей ничего не сделает для рыбака, потому что они очень мобильны индивидуально и не связаны друг с другом и могут быть так легко отброшены, что никакая рыба не может их поймать мог.
Но если вы подключаете потоки к сети, их больше нельзя отталкивать, и пойманная рыба не может выбраться. Химический трюк с пластмассами теперь создает связи между отдельными свободными цепями, так что цепи не могут двигаться так хорошо. Ионически сшитые пластики также называют «иономерами», отрицательно заряженные радикалы - для.
8. Полярность и поляризуемость химической связи. Дипольный момент связи (постоянный и индуцированный). Полярная и неполярная ковалентная связь.
9. Какую ковалентную связь называют σ-связью и какую π-связью? Ответ разберите на конкретных примерах.
10. Что такое гибридизация атомных орбиталей?
11. Какие типы гибридизации являются наиболее важными? Сколько гибридных орбиталей образуется в результате: sp-, sp 2 -, sp 3 - гибридизации?
12. Что такое степень окисления элемента в соединениях с полярной ковалентной связью? Ионная связь как предельно поляризованная ковалентная связь. Гомо- и гетеролитический разрыв связи.
13. Водородная связь. Механизм образования водородной связи. Межмолекулярная и внутримолекулярная водородная связь.
Задания для самоконтроля
1. Дайте определения следующим понятиям:
Химическая связь –
Степень окисления -
Валентность –
Водородная связь –
Энергия связи –
Направленность связи –
Насыщаемость связи –
Полярность связи –
Поляризуемость –
2. Дополните утверждения:
1. Химическая связь, осуществляемая за счет обобществления электронных пар – это_________________ связь.
2. Способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи, называется ___________________.
3. Химическая связь между ионами, осуществляемая за счет электростатического притяжения, называется ____________ связью.
4. Расстояние между центрами атомов в молекуле называется _________________.
3. Выберите из списка вещества, содержащие только ковалентные полярные связи: NH 4 Cl, Al 2 O 3 , CH 4 , KNO 2 , Cr, P 2 O 5 , NH 3 , O 2 .
4. Напишите структурные формулы данных соединений. Выберите пару молекул, в которых число π-связей одинаково.
а) Cl 2 O 7 и P 2 O 5 ; б) CO 2 и C 2 H 2 ;
в) CH 3 COOH и CO 2 ; г) H 2 SO 4 и H 3 PO 4.
5. Число σ-связей увеличивается в ряду:
а) этан, силан, хлорид фосфора (III);
б) гексафторид серы, серная кислота, азотная кислота;
в) этилен, хлорид мышьяка (V), угольная кислота;
г) хлорная кислота, серная кислота, оксид хлора (VII).
6. Полярность связи уменьшается в ряду:
а) NH 3 , PH 3 , AsH 3 ; в) H 2 O, SiH 4 , CH 4 ;
б) HBr, HCl, HF; г) H 2 S, H 2 Se, H 2 O.
7. Укажите, у каких из ниже приведенных молекул химические связи имеют полярный характер:
F 2 , CO, N 2 , HBr, Вr 2 .
8. Дипольные моменты молекул BF 3 и NF 3 равны соответственно 0 и 0,2D. Объясните причины неполярности первой и полярности второй молекул.
9. Используя значения относительных электроотрицательностей атомов, расположите указанные соединения в порядке возрастания ионности связи. К какому из соединяющихся атомов смещено электронное облако и почему?
| а) | NH 3 , PH 3 , AsH 3 , SbH 3 ; |
| б) | BeF 2 , MgF 2 , CaF 2 , BaF 2 ; |
| в) | CF 4 , NF 3 , OF 2 , F 2 ; |
| г) | N 2 O, NO, NO 2 , N 2 O 4 . |
10. Энергия связи уменьшается в ряду:
а) хлорид углерода (IV), хлорид сурьмы (III);
б) хлорид мышьяка (III), хлорид фосфора (III);
в) хлорид олова (IV), хлорид фосфора (V);
г) хлорид ванадия (III), хлорид бора (III).
11. Длина связи уменьшается в ряду:
а) BH 3 , CH 4 , NH 3 ; в) HF, HBr, HI;
б) SiH 4 , HCl, H 2 S; г) H 2 O, PH 3 , HCl.
12. Используя электронно-графические формулы определите валентности йода и фосфора в основном и возбужденном состояниях.
13. Определите степень окисления и валентность атома углерода в приведенных соединениях:
CH 4 ; CH 3 Cl; CH 2 Cl 2 ; CHCl 3 ; CCl 4 .
14. Для соединений H 2 SO 4 и СО 2
а) запишите структурные формулы;
б) определите число s- и p-связей в молекуле;
в) запишите электронные и электронно-графические формулы центрального атома в основном, и, если надо – в возбужденном состоянии;
г) определите тип гибридизации, геометрию молекул;
д) изобразите схемы перекрывания орбиталей.
15. Какие атомы элементов II периода могут быть донорами и акцепторами электронных пар? Чем это определяется? Возможна ли донорная или акцепторная функция для центрального атома в молекулах: BeF 2 , BF 3 , CF 4 , NH 3 , H 2 O, PCl 5 ?
16. Заполните таблицу:
| № | Частица | Геометрическая форма | Тип гибридизации АО | Пространственное изображение частицы | Количество s - и p - связей |
| BeF 2 | Линейная | ||||
| BCl 3 | sp 2 | ||||
| BCl 4 - | |||||
| CF 4 | 4s | ||||
| CO 2 | |||||
| H 2 O | |||||
| H 3 O + | |||||
| GeF 4 | |||||
| NOF |
17. С позиций метода валентных связей покажите образование предложенных молекул. Какие орбитали соединяющихся атомов участвуют в образовании связей? Сколько σ- и π-связей содержат молекулы? Какова пространственная структура каждой молекулы? Каков тип гибридизации атомных орбиталей центрального атома (если есть)? Отметьте полярность связей и полярность молекулы в целом.
а) N 2 ; б) AsH 3 ; в) COCl 2 ; г) H 2 Se.
18. С позиций метода валентных связей объясните механизм образования молекулы SiF 4 и иона SiF 6 2- . Может ли существовать ион СF 6 2- .
Важными количественными характеристиками ковалентной связи являются энергия связи , ее длина и дипольный момент .
Энергия связи – энергия, выделяющаяся при ее образовании, или необходимая для разъединения двух связанных атомов. Энергия связи характеризует ее прочность.
Длина связи – расстояние между центрами связанных атомов. Чем меньше длина, тем прочнее химическая связь.
Дипольный момент связи (μ) – векторная величина, характеризующая полярность связи (измеряется в дебаях D или кулон-метрах: 1D = 3,4·10 -30 Кл·м).
Длина вектора равна произведению длины связи l
на эффективный заряд q
, который приобретают атомы при смещении электронной плотности: | μ | = l
· q
.Вектор дипольного момента направлен от положительного заряда к отрицательному. При векторном сложении дипольных моментов всех связей получают дипольный момент молекулы.
На характеристики связей влияет их кратность:
Ковалентная связь (атомная связь, гомеополярная связь) - химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой .
Термин ковалентная связь был впервые введён лауреатом Нобелевской премии Ирвингом Ленгмюром в 1919 году . Этот термин относился к химической связи, обусловленной совместным обладанием электронами, в отличие от металлической связи, в которой электроны были свободными, или от ионной связи, в которой один из атомов отдавал электрон и становилсякатионом, а другой атом принимал электрон и становился анионом.
Позднее (1927 год) Ф.Лондон и В.Гайтлер на примере молекулы водорода дали первое описание ковалентной связи с точки зрения квантовой механики.
С учётом статистической интерпретации волновой функции М.Борна плотность вероятности нахождения связывающих электронов концентрируется в пространстве между ядрами молекулы (рис.1). В теории отталкивания электронных пар рассматриваются геометрические размеры этих пар. Так, для элементов каждого периода существует некоторый средний радиус электронной пары (Å):
0,6 для элементов вплоть до неона; 0,75 для элементов вплоть до аргона; 0,75 для элементов вплоть до криптона и 0,8 для элементов вплоть до ксенона.
Характерные свойства ковалентной связи - направленность, насыщаемость, полярность, поляризуемость - определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость - способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные - двухатомная молекула состоит из одинаковых атомов (H 2 , Cl 2 , N 2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные - двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождая дипольный момент молекулы).
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Однако, дважды лауреат Нобелевской премии Л. Полинг указывал, что «в некоторых молекулах имеются ковалентные связи, обусловленные одним или тремя электронами вместо общей пары» . Одноэлектронная химическая связь реализуется в молекулярном ионе водорода H 2 + .
Молекулярный ион водорода H 2 + содержит два протона и один электрон. Единственный электрон молекулярной системы компенсирует электростатическое отталкивание двух протонов и удерживает их на расстоянии 1,06 Å (длина химической связи H 2 +). Центр электронной плотности электронного облака молекулярной системы равноудалён от обоих протонов на боровский радиус α 0 =0,53 Å и является центром симметрии молекулярного иона водорода H 2 + .
9- вопрос) Способы образования ковалентной связи. Приведите примеры.
Способы образования ковалентной связи
Существуют два главных способа образования ковалентной связи *.
1) Электронная пара, образующая связь, может образоваться за счет неспаренных электронов, имеющихся в невозбужденныхатомах.
Однако число ковалентных связей может быть больше числа неспаренных электронов. Например, в невозбужденном состоянии (которое называется также основным состоянием) атом углерода имеет два неспаренных электрона, однако для него характерны соединения, в которых он образует четыре ковалентные связи. Это оказывается возможным в результате возбуждения атома. При этом один из s-электронов переходит на p-подуровень:
Увеличение числа создаваемых ковалентных связей сопровождается выделением большего количества энергии, чем затрачивается на возбуждение атома. Поскольку валентность атома зависит от числа неспаренных электронов, возбуждение приводит к повышению валентности. У атомов азота, кислорода, фтора количество неспаренных электронов не увеличивается, т.к. в пределах второго уровня нет свободных орбиталей *, а перемещение электронов на третий квантовый уровень требует значительно большей энергии, чем та, которая выделилась бы при образовании дополнительных связей. Таким образом, при возбуждении атома переходы электронов на свободныеорбитали возможны только в пределах одного энергетического уровня .
Элементы 3-го периода – фосфор, сера, хлор – могут проявлять валентность, равную номеру группы. Это достигается возбуждением атомов с переходом 3s- и 3p-электронов на вакантные орбитали 3d-подуровня:
P* 1s 2 2s 2 2p 6 3s 1 3p 3 3d 1 (валентность 5)
S* 1s 2 2s 2 2p 6 3s 1 3p 3 3d 2 (валентность 6)
Cl* 1s 2 2s 2 2p 6 3s 1 3p 3 3d 3 (валентность 7)
В приведенных выше электронных формулах * возбужденных атомов подчеркнуты подуровни *, содержащие только неспаренныеэлектроны. На примере атома хлора легко показать, что валентность может быть переменной:
В отличие от хлора, валентность атома F постоянна и равна 1, т.к. на валентном (втором) энергетическом уровне отсутствуюторбитали d-подуровня и другие вакантные орбитали.
2) Ковалентные связи могут образовываться за счет спаренных электронов, имеющихся на внешнем электронном слое атома. В этом случае второй атом должен иметь на внешнем слое свободную орбиталь. Например, образование иона аммония из молекулы аммиакаи иона водорода можно отобразить схемой:
Атом, предоставляющий свою электронную пару для образования ковалентной связи *, называется донором, а атом, предоставляющий пустую орбиталь, – акцептором. Ковалентная связь, образованная таким способом, называется донорно-акцепторной связью. В катионе аммония эта связь по своим свойствам абсолютно идентична трем другим ковалентным связям, образованным первым способом, поэтому термин “донорно-акцепторная” обозначает не какой-то особый вид связи, а лишь способ ее образования.
10-вопрос) Кислотно-основное взаимодействие – реакции нейтрализации. Кислые и основные соли. Приведите примеры.
NaOH + HCl = NaCl + H2O - реакция нейтрализации
NaOH + H2SO4 = NaHSO4 + H2O - образование кислой соли гидросульфата натрия, кислые соли могут образовывать иногоосновные кислоты, например Н3РО4 может образовать 2 кислые соли NaH2PO4 . Na2HPO4 . -кислые соли - продукт неполного замещения катионов водорода в кислоте.
Al(OH)3 + 3HCl = AlCl3 + 3H2O - средняя соль
Al(OH)3 + 2HCl = Cl2 + 2H2O - гидроксохлорид алюминия - основная соль
Al(OH)3 + HCl = Cl + H2O - дигидроксохлорид алюминия
Основная соль - продукт неполного замещения гидроксильных групп основания анионами кислотного остатка.
Теории кислот и оснований - совокупность фундаментальных физико-химических представлений, описывающих природу и свойства кислот и оснований. Все они вводят определения кислот и оснований - двух классов веществ, реагирующих между собой. Задача теории - предсказание продуктов реакции между кислотой и основанием и возможности её протекания, для чего используются количественные характеристики силы кислоты и основания. Различия между теориями лежат в определениями кислот и оснований, характеристики их силы и, как следствие - в правилах предсказания продуктов реакции между ними. Все они имеют свою область применимости, каковые области частично пересекаются.
Кислотно-основные взаимодействия чрезвычайно распространенены в природе и находят широкое применение в научной и производственной практике. Теоретические представления о кислотах и основаниях имеют важное значение в формировании всех концептуальных систем химии и оказывают разностороннее влияние на развитие многих теоретических концепций во всех основных химических дисциплинах.
На основе современной теории кислот и оснований разработаны такие разделы химических наук, как химия водных и неводных растворов электролитов, рН-метрия в неводных средах, гомо- и гетерогенный кислотно-основный катализ, теория функций кислотности и многие другие.
11- вопрос) Ионная связь, ее свойства, приведите примеры.
В отличие от ковалентной связи ионная связь не обладает насыщаемостью.
Прочность ионных связей.
Вещества с ионными связями в молекулах, как правило, имеют более высокие температуры кипения и плавления.
Ионная связь - очень прочная химическая связь, образующаяся между атомами с большой разностью (>1,5 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.Это притяжение ионов как разноименно заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %. Рассмотрим способ образования на примере хлорида натрия NaCl. Электронную конфигурацию атомов натрия и хлора можно представить: 11 Na 1s2 2s2 2p 6 3s1; 17 Cl 1s2 2s2 2p6 Зs2 3р5. Это атомы с незавершенными энергетическими уровнями. Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его. Схематично это можно записать так: Na. - l е -> Na+ ион натрия, устойчивая восьми электронная 1s2 2s2 2p6 оболочка за счет второго энергетического уровня. :Cl + 1е --> .Cl - ион хлора, устойчивая восьми электронная оболочка. Между ионами Na+ и Cl- возникают силы электростатического притяжения, в результате чего образуется соединение. Ионная связь - крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы.
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО > 1.7 по Полингу), то общая электронная параполностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью. Вернее, такой взгляд удобен. На деле ионная связь между атомами в чистом виде не реализуется нигде или почти нигде, обычно на деле связь носит частично ионный, а частично ковалентный характер. В то же время связь сложных молекулярных ионов часто может считаться чисто ионной. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Именно поэтому кристаллы, образованные за счёт ионной связи, тяготеют к различным плотнейшим упаковкам соответствующих ионов.
Характеристикой подобных соединений служит хорошая растворимость в полярных растворителях (вода, кислоты и т. д.). Это происходит из-за заряженности частей молекулы. При этом диполи растворителя притягиваются к заряженным концам молекулы, и, в результате Броуновского движения, «растаскивают» молекулу вещества на части и окружают их, не давая соединиться вновь. В итоге получаются ионы окружённые диполями растворителя.
При растворении подобных соединений, как правило, выделяется энергия, так как суммарная энергия образованных связей растворитель-ион больше энергии связи анион-катион. Исключения составляют многие соли азотной кислоты (нитраты), которые при растворении поглощают тепло (растворы охлаждаются). Последний факт объясняется на основе законов, которые рассматриваются в физической химии.
примеры: (MgS, K2CO3), основания(LiOH, Ca(OH)2), основные оксиды(BaO, Na2O)
тип решетки- металлическая
12) Обменные реакции в растворах. Приведите примеры.
В практически необратимых реакциях равновесие сильно смещено в сторону образования продуктов реакции.
Часто встречаются процессы при которых слабые электролиты или малорастворимые соединения входят в число исходных и в число конечных продуктов реакции. Например,
HCN(p) + CH 3 COO - (p)↔ CH 3 COOH(p) + CN - (p) (1), ΔG˚=43кДж
NH 4 OH(p) + H + (p) ↔ H 2 O(ж) + NH 4 + (p) (2) ΔG˚= -84кДж
слабые электролиты есть и в левой и в правой части уравнений.
В этих случаях равновесие обратимого процесса смещается в сторону образования вещества, обладающего меньшей Кдиссоц.
В реакции (1) равновесие смещено влево K HCN = 4,9 · 10 -10 < K CH 3 COOH = 1,8 · 10 -5 , в реакции (2) – сильно сдвинуто вправо (K H 2 O =1,8 · 10 -16 < K NH 4 OH = 1,8 · 10 -5).
Примерами процессов в уравнении реакции которых слева и справа входят труднорастворимые вещества , могут служить:
AgCl(k)↓ + NaI(p) ↔ AgI↓(k) + NaCl(p) (1) ΔG˚= - 54кДж
BaCO 3 ↓(k) + Na 2 SO 4 (p) ↔ BaSO 4 ↓(k) + Na 2 CO 3 (p) (2) ΔG˚≈ 0
Равновесие смещается в сторону образования менее растворимого соединения. В реакции (1) равновесие смещено вправо, т.к. ПРAgI=1,1·10 -16 < ПРAgCl =1,8·
10 -10 . В реакции (2) равновесие лишь несколько сдвинуто в сторону BaSO 4
(ПР BaCO 3 = 4,9·10 -9 > ПР BaSO 4 =1,08·10 -10).
Встречаются процессы в уравнениях которых с одной стороны равенства имеется малорастворимое соединение, а с другой стороны – слабый электролит. Так, равновесие в системе
AgCN(k)↓ + H + (p) ↔ HCN(p) + Ag + (p) ΔG˚= - 46кДж
значительно смещено вправо, поскольку ион СN - более прочно связывается в молекулу очень слабого электролита HCN, чем в молекулу малорастворимого вещества AgCN. Поэтому осадок AgCN растворяется при добавлении азотной кислоты.
