Опорный конспект Химическая связь. Строение вещества
Конспект уроков химии по теме "Типы химической связи"
Дата публикации: 27.12.2015
Краткое описание:
предварительный просмотр материала
Конспекты уроков по теме: «Типы химической связи».
11 класс, МБОУ ССШ № 7 городского округа - город Камышин Волгоградской области.
Учитель химии Золотарева Татьяна Генриховна.
Пояснительная записка.
Данный блок уроков рассчитан на учащихся 11-ых классов, обучающихся по программе О.С. Габриеляна, профильного уровня. При разработке данного блока уроков использовалась педагогическая технология «Прогрессирующая кооперация». Суть этой технологии в том, что от урока к уроку учащиеся накапливают знания по заданной теме. Процесс завершается контрольным тестированием. Учитель использует различные интерактивные формы и методики развивающего характера для успешного усвоения знаний учащимися. Выполнение домашних заданий требует от учащихся самостоятельности, творчества, использования различных источников информации, консультации друг с другом и учителем. Совместная деятельность учителя и учащихся в конечном итоге направлена на успешную сдачу ЕГЭ.
Цель: углубить, закрепить, обобщить и проконтролировать уровень знании учащихся о типах химической связи, структуре кристаллической решетки и характерных свойствах веществ.
Мотивация: успешная сдача ЕГЭ по химии.
Опираясь на знания ковалентной, ионной и металлической связи сделать вывод о единой природе химической связи;
В ходе тестирования закрепить умения определять тип химической связи и вид кристаллической решетки для конкретных химических веществ;
Способствовать формированию представления учащихся о том, что деление на типы связей носит условный характер.
Оборудование: мультимедийная система, компьютер.
Блок уроков по теме «Типы химических связей»:
Урок углубления и закрепления знаний учащихся по типам химических связей и видам кристаллических решеток. Ребята должны проследить взаимосвязь между строением и свойствами веществ. Проводится с использованием технологии проблемного обучения.
Урок закрепления и обобщения знаний учащихся по заданной теме с использованием групповой технологии (интерактивные группы учащихся) и мультимедийных презентаций по темам «Ионная связь», «Металлическая связь», «Ковалентная связь», «Водородная связь»(индивидуальная работа учащихся).
Контрольное тестирование по заданной теме. Тесты составлены с использованием сборников тестов ФИПИ «ЕГЭ химия 2015».
Конспект урока № 1 «Типы химической связи».
Цель урока : повторить, закрепить и углубить знания о типах химических связей, структуре кристаллической решетки и характерных свойствах веществ.
Задачи урока :
1. Повторить, углубить и закрепить важнейшие сведения о химической связи и строении вещества
Оборудование
Ход урока:
Здравствуйте ребята! Мне хотелось бы начать урок со слов Нансена, известного педагога-психолога «Жизненные позиции заразительны … А ваша может кого то увлечь?». Свою жизненную позицию я вижу в том, чтобы помочь вам овладеть компетенциями, которые в дальнейшем помогут вам успешно сдать ЕГЭ по химии, что позволит вам поступить в выбранные вами учебные заведения.
Тема нашего урока «Типы химических связей», цель урока - повторить, закрепить и углубить знания о типах химических связей, структуре кристаллической решетки и характерных свойствах веществ.
Задачи урока смотри выше.
Объяснение нового материала :
1. Актуализация опорных понятий и навыков.
Учитель. Учение о химической связи составляет основу всей теоретической химии.
Что мы понимаем под химической связью?
Возможный вариант ответа: под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
Образование между частицами химических связей приводит к уменьшению общего запаса энергии системы по сравнению с суммой энергий несвязанных атомов.
Какие частицы могут принимать участие в образовании химической связи?
Возможный вариант ответа: В образовании химических связей могут принимать участие
Неспаренные валентные электроны
Пара валентных электронов, находящихся на одной орбитали
Вакантная орбиталь.
Различают четыре типа химической связи. Какие?
Возможный вариант ответа: ионная, ковалентная, металлическая и водородная.
Давайте выполним следующее задание: разделите вещества по типу химической связи на три группы. Формулы и названия веществ записаны на доске. Это медь, кислород, углекислый газ, угарный газ, гидроксид натрия, хлорид калия, карбонат кальция, железо, водород, азот, вода, аммиак, гидроксид бария, хлорид магния, карбид кальция, хлорид аммония. При выполнении задания, вы можете использовать схему № 1
Ребята, посмотрите внимательно на вещества и скажите, в каких из них может быть несколько типов химической связи.
Возможный вариант ответа: гидроксид натрия, карбонат кальция, гидроксид бария, карбид кальция.
Какие в этих веществах типы химической связи?
Анализируем по схеме «Типы химических связей» и делаем выводы.
2. Углубленное изучение материала, через постановку проблемы.
Постановка проблемы: ребята, что вы можете сказать о веществе, которое состоит из химических элементов, номера которых в периодической системе 1 и 34.
Возможный вариант ответа: это водородное соединение селена, формула H2Se.
А можем ли мы сказать, какое строение имеет это вещество, и какими свойствами оно обладает?
Чтобы ответить на этот вопрос я предлагаю вам составить таблицу «Типы химической связи».
ческая связь
Соединяющиеся частицы
Механизм возникнове
Силы, удерживающие частицы
Примеры веществ
Характерные свойства
Начинаем работать.
Химическая связь, образовавшаяся за счет электростатического притяжения катионов к анионам между атомами с большой разностью электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью называется ионной. Приводим примеры веществ с ионной связью и отмечаем характерные свойства веществ ионного строения - твердость, тугоплавкость, способность проводить электрических ток в расплавленном виде и в виде водного раствора(при условии, что вещество растворимо в воде).
Ребята составьте схему образования связи в хлориде натрия и уравнение диссоциации этого вещества.
Ученик работает у доски.
Связь в металлах и сплавах между атом-ионами металлов, расположенных в узлах кристаллической решетки, которая осуществляется обобществлением валентных электронов называется металлической. Приводим примеры веществ с металлической связью и характерные свойства: металлический блеск, электропроводность, теплопроводность, ковкость, пластичность.
Ребята составьте схему образования химической связи для алюминия.
Ученик работает у доски.
Связь, возникающая между атомами за счет образования общих пар электронов называется ковалентной. С какими видами ковалентной связи вы знакомы?
Возможный вариант ответа: ковалентная полярная и ковалентная неполярная связь.
Какую связь мы называем ковалентной неполярной?
Возможный вариант ответа: ковалентная химическая связь между атомами с одинаковой электроотрицательностью, называют неполярной.
Какую связь мы называем ковалентной полярной?
Возможный вариант ответа: ковалентная химическая связь между атомами, разность электроотрицательностей которых меньше 1,7 называется полярной.
Ребята, какое свойство атома мы называем электроотрицательностью?
Возможный вариант ответа: свойство атома оттягивать к себе валентные электроны от других атомов называется электроотрицательностью.
Какие кристаллические решетки образуют вещества с ковалентной связью в твердом состоянии?
Возможный вариант ответа: молекулярные и атомные.
Приводим примеры веществ с ковалентной полярной и ковалентной неполярной химической связью, молекулярного и атомного строения и характерные свойства веществ: молекулярного строения - газообразные вещества, легкокипящие жидкости, твердые легкоплавкие вещества, неэлектролиты(исключения сильные кислоты и растворимые в воде соли), атомного строения - прочная кристаллическая решетка, твердые, плохо растворимы в воде вещества, неэлектролиты.
Ребята составьте схемы образования связи в молекулах водорода, кислорода, азота.
У доски работают 3 ученика.
Какие типы ковалентной связи по способу перекрывания орбиталей вам известны?
(работаем по схеме «Виды и формы электронных орбиталей)
Возможный вариант ответа: по способу перекрывания электронных орбиталей различают сигма и пи ковалентные связи. В первом случае орбитали перекрываются по линии соединяющей ядра атомов, во втором случае - боковое перекрывание орбиталей.
Ребята у доски закончили работу.
Какие типы ковалентной связи по числу общих электронных пар, связывающих атомы, то есть по кратности, вы знаете? (работа с учебником стр.50). Анализируем работу учащихся у доски.
Возможные варианты ответов:
Одинарные, пример на доске водород. Пример органических веществ - предельные углеводороды.
Двойные, пример на доске кислород. Пример органических веществ - алкены.
Тройные, пример на доске азот. Пример органических веществ - алкины.
Ребята необходимо отметить, что механизмы образования ковалентной связи различны (работа с учебником стр.47-48):
1. Обменный механизм - атомы образуют общие электронные пары за счет объединения неспаренных электронов.
2. Донорно-акцепторный - один из атомов донор предоставляет пару электронов для образования связи, другой атом акцептор - свободную орбиталь.
Приведем примеры.
Возможный вариант ответа: связи в молекуле хлороводорода, хлора. Связь в ионе аммония.
Какими свойствами обладает ковалентная связь?
Возможный вариант ответа: насыщаемость, поляризуемость, направленность.
На что влияет направленность ковалентной связи?
Возможный вариант ответа: на геометрию молекулы, то есть на форму молекул, их размеры, межатомные расстояния, валентный угол.
С какими типами гибридизации мы познакомились при изучении органических веществ? (работаем с использованием схемы «Гибридные орбитали»)
Возможный вариант ответа: sp3, sp2, и sp гибридизация.
Какие углы связи характерны для данных видов гибридизации?
Возможный вариант ответа: 109 градусов 28 минут, 120 градусов, 180 градусов соответственно.
Какую форму имеют молекулы с соответствующим типом гибридизации орбиталей?
Возможный вариант ответа: тетраэдрическую, плоскую треугольную, линейную соответственно.
Приводим примеры. В случае затруднений обратиться к учебнику стр.61-63.
Химическую связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно поляризованными атомами сильно электроотрицательных элементов, имеющих неподеленные электронные пары другой молекулы (или ее части), называют водородной)
Механизм образования водородной связи имеет частично электростатический, частично донорно-акцепторный характер.
Приведите примеры веществ с данным типом связи.
Возможный вариант ответа: вода, спирты, аммиак, фтороводород - межмолекулярная водородная связь; белки и нуклеиновые кислоты - внутримолекулярная водородная связь.
Какие свойства характерны для этих веществ?
Возможный вариант ответа: более высокие температуры кипения, в сравнении со сходными веществами, между молекулами которых отсутствуют водородные связи. Например - вода и углекислый газ.
Решение проблемы . Ребята, мы закончили заполнять таблицу «Типы химической связи» (смотри приложения). Вернемся к началу урока. Что вы можете сказать о свойствах селеноводорода?
Возможный вариант ответа: Селеноводород - вещество с ковалентным полярным типом химической связи, молекулярного строения, слабый электролит, при нормальных условиях является газом, с неприятным запахом, водный раствор является кислотой. Записываем уравнение диссоциации селеноводорода. Ученик работает у доски.
Итоги урока.
Ребята, какие выводы мы можем сделать?
Возможный вариант ответа: чтобы определиться со свойствами вещества, необходимо знать тип химической связи и особенности его строения и наоборот.
Обратите внимание на четвертый столбец нашей таблицы. Что вы можете сказать о природе химической связи.
Возможный вариант ответа: физическая природа химической связи едина.
Выставление отметок за урок .
Конспект урока № 2 «Типы химической связи».
Цель урока : закрепить, углубить и обобщить знания о типах химических связей, структуре кристаллической решетки и характерных свойствах веществ.
Задачи урока :
1. Углубить, закрепить и обобщить важнейшие сведения о химической связи и строении вещества
Уметь определять вид химической связи в простых и сложных веществах, составлять схемы образования веществ с различными видами связи
Уметь составлять причинно-следственную связь при рассмотрении вопроса: тип связи - тип кристаллической решетки - свойства вещества.
Оборудование: компьютер, мультимедийная система.
Ход урока:
Организационно-мотивационный блок.
Здравствуйте ребята, я рада нашей новой встрече. Сегодня мы продолжим изучать тему «Типы химической связи», которую мы начали изучать на прошлом уроке. «О сколько нам открытий чудных готовит просвещенья дух, и опыт сын ошибок трудных и гений - парадоксов друг…» - писал А.С. Пушкин. Не перестаю удивляться актуальности этих строк в наше время и гениальности великого русского поэта. Казалось бы, мы с вами уже все знаем о типах химической связи, а заглянешь в книгу, прочтешь и вдруг осознаешь, что есть что-то новое. То на, что ранее не обратил своего внимания. Человек учится всю жизнь. Давайте же и мы начнем…
Какова же цель нашего урока?
Цель урока - закрепить, углубить и обобщить знания о типах химических связей, структуре кристаллической решетки и характерных свойствах веществ.
Какие задачи вы ребята определяете для себя? (смотри выше)
Деление на группы . Ребята, я предлагаю вам разделиться на группы. Те, кто лучше разбирается в ионной связи - группа № 1, кому по душе металлическая связь - группа № 2, знатоки ковалентной связи - группа № 3, поклонники водородной связи - группа № 4.
Углубление, закрепление и обобщение знаний, умений и навыков :
Правила работы в группах : сначала вы прослушаете презентацию «Ионная химическая связь», которую подготовил … . Затем представители других групп задают вопросы ребятам из первой группы, а они отвечают на поставленные вопросы. Если группа не сможет дать ответ на вопрос, то помочь им могут ребята из других групп или учитель. Если важные вопросы не будут освещены, учитель вправе сам задать вопрос. Далее - презентация «Металлическая химическая связь», ее подготовил … . И обсуждение в группах. Далее презентация «Ковалентная химическая связь» , представит ее … . Обсуждение в группах. По окончании презентация «Водородная химическая связь», которую подготовил … . И обсуждение ее в группах. Старшие групп - ребята, подготовившие презентации оценят вклад каждого участника группы. По итогам работы каждый получит отметку. Если нет вопросов, то начинаем работу.
Работа в группах по углублению, закреплению, обобщению и систематизации знаний.
Презентация «Ионная химическая связь». (Прилагается)
Вопросы для обсуждения:
Какую связь называют ионной?
Как атомы превращаются в ионы?
Что представляет собой процесс восстановления?
Что представляет собой процесс окисления?
Какие вы знаете ионы?
Между какими атомами возникает ионная химическая связь?
Каков механизм ионной связи?
Какие силы возникают между катионами и анионами?
В каких веществах ионный тип химической связи?
Какой тип кристаллической решетки характерен для этих веществ?
Какими свойствами обладают вещества с ионным типом химической связи?
Обладает ли ионная связь направленностью?
Презентация «Металлическая химическая связь». (Прилагается)
Вопросы для обсуждения
Какую связь мы называем металлической?
Является ли металличекая связь направленной и насыщенной?
Каков механизм образования металлической связи?
Какие силы действуют между электронами и катионами металлов?
Какими свойствами обладают вещества с металлическим типом связи?
Какие кристаллические решетки образуют металлы?
Какой тип химической связи у металлов в парообразном состоянии?
Что такое полиморфизм металлов?
Какие вещества называют интерметаллидами?
Презентация «Ковалентная химическая связь». (Прилагается)
Вопросы для обсуждения:
Какую связь мы называем ковалентной?
Каковы механизмы образования ковалентной связи?
Какие виды ковалентной связи по способу перекрывания электронных орбиталей вы знаете?
Какие виды ковалентной связи по числу общих электронных пар вам известны?
Какие виды ковалентной связи по степени смещенности общих электронных пар вам известны?
Какое свойство атома мы называем электроотрицательностью?
Объясните, почему молекула углекислого газа не является полярной, а молекула воды - полярна?
Что мы понимаем под насыщаемостью ковалентной связи?
Что такое поляризуемость и направленность ковалентной связи?
Что такое гибридизация атомных орбиталей?
С какими видами гибридизации вы знакомы?
Каковы углы связи в разных типах гибридизации атомных орбиталей?
Какие формы имеют молекулы веществ с разными типами гибридизации?
Что такое длина связи, и в каких единицах она изменяется?
Какие силы удерживают электроны и ядра атомов?
Какие вы знаете вещества с ковалентным типом связи?
Какие типы кристаллов образуют эти вещества в твердом состоянии?
Какие свойства характерны для этих веществ?
Презентация «Водородная химическая связь. Межмолекулярные взаимодействия». (Прилагается)
Вопросы для обсуждения:
Какую связь мы называем водородной?
Каков механизм водородной связи?
Между молекулами, каких веществ возникает водородная химическая связь? Как ее называют?
В молекулах, каких веществ встречается водородная химическая связь? Как ее называют?
Как влияет водородная связь на температуру кипения вещества?
Как называют силы межмолекулярного взаимодействия?
Какие виды межмолекулярных взаимодействий вам знакомы?
Что мы понимаем под ориентационным, индукционным и дисперсионным взаимодействием?
Какова природа химической связи?
При каких условиях возможен переход из одного вида связи в другой? Приведите примеры.
По окончании работы учеников у доски подводятся итоги урока.
Итоги урока .
Ребята, сегодня на уроке вы узнали много о химической связи, мы углубили и обобщили знания о типах химической связи, узнали о механизмах образования связи, привели примеры веществ с различными типами связи и отметили характерные свойства этих веществ. Наконец сделали вывод о единой природе химической связи. Скажите, что же нового вы узнали на уроке, того, на что не обратили внимание ранее? Ответы учеников.
Выставление отметок.
Работа ребят оценивается не только учителем, но и лидерами и участниками групп. Каждый ученик получает отметку за свою работу на уроке.
Домашнее задание :
Подготовиться к контрольному тестированию по теме «Типы химической связи»: параграф 6 и 7, письменно выполнить задания 4 и 5 после параграфа 6, записи в тетради.
Конспект урока № 3 «Типы химической связи».
Цель урока : контроль знаний, умений и навыков по заданной теме.
Задачи урока :
1. Повторить, закрепить и проконтролировать знания о типах химической связи и строении вещества
2. Уметь определять вид химической связи в простых и сложных веществах, составлять схемы образования веществ с различными видами связи
Сформировать умения работы с тестами.
Оборудование : компьютер, мультимедийная система.
Ход урока :
Организационно-мотивационный блок.
Здравствуйте ребята, я рада снова видеть вас на уроке химии. Есть хорошее выражение - «всему свое время», «есть время разбрасывать камни, а есть время собирать их». Выражаясь этим языком, пришло время собирать камни. На прошлом уроке мы изучили тему «Типы химической связи» и сегодня мы узнаем, насколько хорошо разобрались с пройденным материалом. Я предлагаю вам тесты, которые составлены с помощью сборников тестов ФИПИ «ЕГЭ химия 2010». Выполнение этих заданий поможет вам успешно сдать экзамен по химии по окончании 11 класса.
Повторение, закрепление и контроль знаний, умений и навыков
Фронтальная беседа по вопросам предыдущего урока
Проверка домашнего задания
Тестирование по теме «Типы химической связи»
Два варианта тестов прилагаются.
Итоги урока
Ребята, давайте вспомним, какие задачи мы ставили перед собой, когда начинали изучать данную тему. Скажите, мы выполнили поставленные задачи.
Ответы учеников.
Домашнее задание :
Письменно ответить на вопросы после параграфа 7.
Вариант 1.
Какой тип химической связи в сероуглероде
металлическая
ковалентная полярная
ковалентная неполярная
Атом является структурной частицей в кристаллической решетке
водорода
кислорода
Вещества с ионной связью приведены в ряду
1. хлор, аммиак, хлороводород
2. бромоводород, бром, вода
3. сероводород, вода, сера
4. йодоводород, вода, аммиак
4.Кристаллическая решетка железа
2. молекулярная
3. атомная
4. металлическая
5. Какой тип химической связи в хлориде бария
2. ковалентная
3. водородная
4. металлическая
2. оксид натрия
3. углекислый газ
4. белый фосфор
1. вода и сероводород
2. бромид калия и азот
3. аммиак и водород
4. кислород и хлор
8. Вещества, обладающие твердостью, тугоплавкостью, хорошей растворимостью в воде, как правило, имеют кристаллическую решетку
1. молекулярную
2. атомную
4. металлическую
2. этилового спирта
3. этилена
4. ацетилена
10. Какой тип химической связи в бромиде лития
1. ковалентная полярная
2. ковалентная неполярная
11. В каком ряду все вещества имеют ковалентную полярную связь
1. хлороводород, хлорид натрия, хлор 3. Хлорид бария, водород, азот
2. кислород, вода, углекислый газ 4. вода, аммиак, метан
12. Ковалентная неполярная связь реализуется в соединении
1. оксид кальция
2. углекислый газ
3. сернистый газ
13. В молекуле хлора химическая связь:
1. ковалентная полярная
2. ковалентная неполярная
4. водородная.
14. Химическая связь в молекуле фтороводорода:
1. ковалентная полярная
2. ковалентная неполярная
4. металлическая
15. В йодиде калия химическая связь:
1. ковалентная полярная
2. ковалентная неполярная
4. металлическая
16. В сероуглероде химическая связь:
1. ковалентная полярная
2. ковалентная неполярная
4. металлическая
17.Между атомами элементов с порядковыми номерами 11 и 17 возникает связь
1. ковалентная полярная
2. ковалентная неполярная
4. металлическая
18. Ковалентная полярная связь характерна для
1. хлорида калия
2. бромоводорода
3. белого фосфора
4. хлорида кальция
19 Ковалентная неполярная связь характерна для
А) цинк 1) ионная
Б) азот 2) металлическая
В) аммиак 3) ковалентная неполярная
Г) хлорид кальция 4) ковалентная полярная
Тестирование по теме «Типы химической связи».
Вариант 2.
Какой тип химической связи в аммиаке
2. металлическая
3. ковалентная полярная
4. ковалентная неполярная
2. Атом является структурной частицей в кристаллической решетке
2. водорода
3. кислорода
4. кремнезема
3. Вещества с ионной связью приведены в ряду
1. хлор, аммиак, хлороводород
2. бромоводород, бром, вода
3. хлорид натрия, оксид бария, гидроксид калия
4. йодоводород, вода, аммиак
4. Кристаллическая решетка серебра
2. молекулярная
3. атомная
4. металлическая
5. Какой тип химической связи в хлориде натрия
2. ковалентная
3. водородная
4. металлическая
6. Кристаллическую структуру, подобную структуре алмаза имеет
2. оксид натрия
3. углекислый газ
4. белый фосфор
7. Соединениями с ковалентной неполярной связью являются
1. вода и сероуглерод
2. бромид калия и азот
3. аммиак и водород
4. кислород и хлор
8. Вещества, обладающие хрупкостью и легкоплавкостью, как правило, имеют кристаллическую решетку
1. молекулярную
2. атомную
4. металлическую
9. Водородная связь образуется между молекулами
2. уксусной кислоты
3. этилена
4. ацетилена
10.Наиболее прочная химическая связь в молекуле
11. Ионный характер связи наиболее выражен в соединении:
1. хлорид углерода
2. оксид кремния
3. бромид кальция
12. В аммиаке тип химической связи
1. ковалентная полярная 3. ионная
2. ковалентная неполярная 4. металлическая
13. Соединение с ковалентной неполярной связью:
1. хлороводород 3. хлорид кальция
2. кислород 4. вода
14. Водородная связь образуется между молекулами
2. этилового спирта
3. диэтилового эфира
4. метилацетата
15. Путем соединения атомов одного и того же химического элемента образуется связь:
1. ковалентная полярная
2. ковалентная неполярная
4. водородная
16. В аммиаке и хлориде бария химическая связь соответственно
1. ковалентная полярная и ионная
2. ковалентная неполярная и ионная
3. ионная и металлическая
4. металлическая и ковалентная полярная
17. Соединениями с ковалентной полярной и неполярной связью являются соответственно
1. вода и сероводород
2. бромид калия и азот
3. аммиак и водород
4. кислород и метан
18. Атомы химических элементов второго периода Периодической системы образуют соединение с ионной химической связью
1. сульфид бария
2.углекислый газ
3. оксид алюминия
4. фторид лития
19. В каком ряду записаны формулы веществ только с ковалентной полярной связью
1. хлор, аммиак, хлороводород
2. бромоводород, бром, вода
3. сероводород, вода, сера
4. йодоводород, вода, аммиак
20. Установите соответствие между веществом и типом связи атомов в этом веществе:
А) водород 1) ионная
Б) барий 2) металлическая
В) фтороводород 3) ковалентная неполярная
Г) фторид бария 4) ковалентная полярная
Если материал вам не подходит, воспользуйтесь поиском
Подготовка к ВНО. Химия.
Конспект 6. Химическая связь
Природа химической связи
Способы образования химической связи различны, поэтому и выделяют несколько типов химической связи:
1. Ковалентная
2. Водородная
3. Металлическая
4. Ионная.
Каждый химический элемент обладает своей способностью притягивать к себе внешние, чужие электроны.
Электроотрицательность
Способность атома притягивать к себе электроны называется электроотрицательностью.
Электроотрицательность нельзя выразить в единицах любых физических величин. Поэтому было разработано несколько шкал относительной электроотрицательности.
Шкала электроотрицательности.
Наибольшее признание получила шкала электроотрицательности, разработанная Л.К. Полингом.
Чем меньше электронов требуется атому для завершения внешнего электронного уровня, тем большим значением электроотрицательности он обладает.
Например, если сравнить хлор и серу, то большим значением электроотрицательности будет обладать хлор. Ему до достижения октета электронов требуется всего 1 электрон, а атому серы – 2.
Электронная конфигурация внешнего слоя

В периоде
электроотрицательность будет возрастать слева направо
.
Если же рассматривать элементы одной группы
, которые имеют на внешнем слое одинаковое количество электронов, то большим значением электроотрицательности будет обладать тот элемент, у которого меньше радиус. Т.е. тот, который находится выше по группе
.
Сравнивая фтор и хлор можно с уверенностью сказать, что фтор ![]() обладает большей электроотрицательностью, чем хлор
обладает большей электроотрицательностью, чем хлор ![]() .
.
Фтор самый электроотрицательный элемент. Наименьшим значением электроотрицательности обладают щелочные металлы.
Ионная связь
Ионная связь – это связь между атомами резко отличающими по электроотрицательности:
у одного она очень высокая, у другого – низкая.
В этом случае, атом с меньшей электроотрицательностью полностью отдает свои валентные электроны атому с большей электроотрицательностью.
Ионная связь образуется между металлами и неметаллами.
Такой тип связи в ![]() и др. При образовании ионной связи образуются заряженные частицы: ионы.
и др. При образовании ионной связи образуются заряженные частицы: ионы.
Катионы
– положительно заряженные ионы. Их образуют атомы, в которых мало валентных электронов и они слабо связаны с ядром. Это атомы щелочных и щелочноземельных металлов.
Анионы
– отрицательно заряженные ионы. Их легче всего образуют галогены. Элементы главной подгруппы 7 группы. До завершения валентного уровня им не хватает всего одного электрона.
Схема образования ионной связи на примере хлорида натрия.

Атом натрия, имеет на внешнем уровне всего один электрон. Он легко отдает его, превращаясь в катион натрия . Атому хлора до октета электронов не хватает одного электрона. Он его забирает у атома натрия, превращаясь в анион хлора
Ионная связь возникает за счет сил электростатического притяжения разноименно заряженных ионов.
Ковалентная связь
Ковалентная неполярная связь.
Образование связи между двумя атомами водорода в молекуле водорода .
![]()
Химическая связь образуется в результате перекрывания атомных орбиталей. В этом случае между ядрами двух атомов образуется область повышенной электронной плотности. Такое состояние энергетически выгодно для обоих атомов, так как в данном случае оба электрона в равной степени принадлежат обоим атомам. Образование связи в молекуле водорода можно показать как с помощью перекрывания атомных орбиталей
, так и с помощью формул Льюиса. Два электрона стали общими для обоих атомов водорода. Так как в атоме водорода всего один электронный слой, и он завершен, если на нем два электрона, такое состояние выгодно для обоих атомов – образовалась химическая связь.
Химическая связь, образующаяся в результате перекрывания атомных орбиталей, при котором пара электронов становится общей для обоих атомов, называется ковалентной связью.
Обратите внимание
: при ковалентной связи пара электронов
становится общей для обоих атомов
. Образование молекулы водорода – это пример ковалентной связи. При этом область повышенной электронной плотности находится посередине относительно центров ядер атомов
, то есть пара электронов в равной степени принадлежит обоим атомам водорода. Такая связь называется ковалентной неполярной связью.
Химическую связь между атомами элементов, в результате которой электроны в равной степени принадлежат обоим атомам, называют ковалентной неполярной связью.
Ковалентная полярная связь.
Ковалентная полярная связь в молекуле хлороводорода.
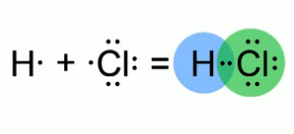
Зная, что ковалентная связь образуется за счет общих электронных пар, изобразим модель молекулы хлороводорода. Атом водорода имеет на внешнем электронном слое всего один электрон. Атом хлора – семь электронов. Эти атомы приобретут энергетически выгодное состояние, если атому водорода будет принадлежать два электрона, а атому хлора – восемь. Такое возможно при образовании одной общей электронной пары. Связь, образующаяся между водородом и хлором, в молекуле хлороводорода отличается от той химической связи, которая реализуется в молекулах простых веществ водорода и хлора. Это подтверждают экспериментальные данные. Например: атом водорода в молекуле , может замещаться на атомы металла, а раствор хлороводорода в воде проводит электрический ток. Общая электронная пара между двумя атомами не находится в равноудаленном от них положении. Например, в молекуле хлороводорода электронная плотность на атоме хлора (это элемент с более высокой электроотрицательностью) выше, чем у атома водорода. В молекуле хлороводорода химическая связь – полярная.
Металлическая связь
Металлическая связь - это тип связи в металлах и их сплавах между атомами или ионами металлов и относительно свободными электронами (электронным газом) в кристаллической решетке.
Металлическая связь.
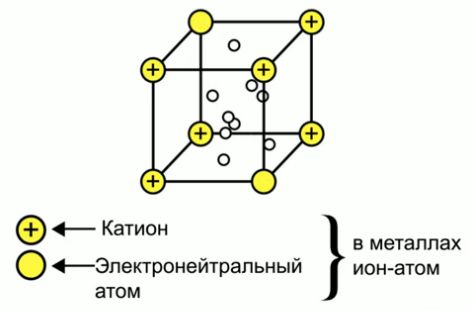
В металлах валентные электроны удерживаются атомами крайне слабо и способны мигрировать. Атомы, оставшиеся без внешних электронов, приобретают положительный заряд. Они образуют металлическую
кристаллическую решётку.
Совокупность обобществлённых валентных электронов (электронный газ), заряженных отрицательно, удерживает положительные ионы металла в определённых точках пространства – узлах кристаллической решётки.
Внешние электроны могут свободно и хаотично перемещаться, поэтому металлы характеризуются высокой электропроводностью (особенно золото, серебро, медь, алюминий).
Водородная связь
При изучении многих веществ были обнаружены так называемые водородные связи
.
Водородная связь
образуется между сильно поляризованным, обладающим значительной долей положительного заряда атомом водорода
и другим атомом с очень высокой электроотрицательностью: фтором, кислородом или азотом.
Например, молекулы в жидком фтороводороде связаны между собой водородной связью.
Аналогично связаны молекулы в жидкой воде или в кристалле льда.
Водородная связь в молекуле воды.
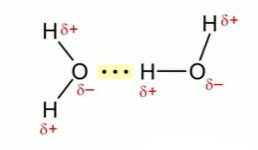
Молекулы и между собой в межмолекулярном соединении – гидрате аммиака ![]() связаны водородной связью.
связаны водородной связью.
Водородные связи малоустойчивы и разрушаются довольно легко (например
, при плавлении льда, кипении воды). Однако на разрыв этих связей затрачивается некоторая дополнительная энергия, и поэтому температуры плавления и кипения веществ с водородными связями между молекулами оказываются значительно выше, чем у подобных веществ, но без них.
Тесты подготовки к ЗНО:
Задачи урока: Изучить виды химической связи в теме «строение вещества», на данном уроке разобрать причины и механизмы образования ионной связи. Познакомить: с типами ионных кристаллических решеток; с физическими свойствами веществ кристаллических решеток. Знать основные понятия: химическая связь, ионная химическая связь, ионные кристаллические решетки. Уметь определять ионную связь.
![]()
Это связь, образовавшаяся за счет электростатического притяжения катионов к анионам. Главный закон химической реакции - заполнение валентного энергетического уровня. Когда валентный энергетический уровень заполнен - элемент становится стабильным или насыщенным.
Натрий - Na, щелочной металл (группа IA). Электронная конфигурация: 1s 2 2s 2 2p 6 3s 1 Как видим, натрий имеет один валентный электрон, который он "согласен" отдать, чтобы его энергетические уровни стали завершенными.
Хлор - Cl, галоген (группа VIIA). Электронная конфигурация: 1s 2 2s 2 2p 6 3s 2 3p 5 Как видим, хлор имеет 7 валентных электронов и ему "не хватает" одного электрона, чтобы его энергетические уровни стали завершенными.

Почему "дружны" атомы хлора и натрия?

На внешнем энергетическом уровне атома натрия находится один электрон. Для перехода в стабильное состояние, натрий должен: отдать этот электрон, у него "исчезает" 3s-орбиталь, а количество протонов (11) будет на один превосходить количество электронов (10). Поэтому, нейтральный атом натрия превратится в положительно заряженный ион - катион. Электронная конфигурация катиона натрия: Na + 1s 2 2s 2 2p 6 Такая же электронная конфигурация и у неона (Ne).

Так что же, натрий превратился в неон? Вовсе нет - не забывайте о протонах! Их по-прежнему; у натрия - 11; у неона Говорят, что катион натрия является изоэлектронным неону (поскольку их электронные конфигурации одинаковы).

Подведем итог: атом хлора примет один электрон и станет отрицательно заряженным анионом (17 протонов и 18 электронов); электронная конфигурация хлора: Cl - 1s 2 2s 2 2p 6 3s 2 3p 6 анион хлора является изоэлектронным аргону (Ar); поскольку внешний энергетический уровень хлора "достроился", то радиус катиона хлора будет немного больше, чем у "чистого" атома хлора.

Другие соли образуются по аналогичному принципу, что и хлорид натрия. Металл отдает электроны, а неметалл их получает. Из периодической таблицы видно, что: элементы группы IA (щелочные металлы) отдают один электрон и образуют катион с зарядом 1 + ; элементы группы IIA (щелочноземельные металлы) отдают два электрона и образуют катион с зарядом 2 + ; элементы группы IIIA отдают три электрона и образуют катион с зарядом 3 + ;
Cl Na
В кристалле хлорида натрия нельзя выделить отдельные молекулы соли. Их нет. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов Na + и Cl -, Na n Cl n, где n - большое число. Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи.
Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и уменьшению прочности связи между ними. Поэтому расплавы их проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде. 25
Габриелян О.С., Лысова Г.Г. «Учебник химии», 11 класс.
Тема: Природа химической связи. Ковалентная связь
Цель: развивать представление о природе возникновения химической связи, о разновидностях химической связи.
Задачи:
1.сформировать представление о возникновении химической связи, о ее разновидностях;
2.содействовать развитию мышления, способствовать формированию приемов учебной работы, умение работать с информацией;
3.содействовать воспитанию доброжелательного отношения друг к другу, чувства взаимопомощи и сотрудничества.
Тип урока: урок формирования новых знаний и умений.
Метод: словесный, наглядный
Средства обучения: учебник, презентация
Деятельность учителя
Деятельность учеников
Организационный момент (1 мин )
Приветствие, проверка готовности к уроку, проверка отсутствующих
Приветствие, подготовка к уроку
Актуализация знаний (7 мин)
2.1.Проверка домашнего задания
(4 мин)
2.2.Мотивация
(3 мин)
Фронтальный опрос класса
Мотивирует изучение новой темы, обеспечивает включение учащихся в изучение новой темы
Слушают, отвечают на вопросы
Осмысливают, анализируют тему
Формирование новых знаний
(25 мин)
3.1.Понятие химической связи (8 мин)
3.2.Ковалентная связь (8 мин)
3.3.Физминутка (2 мин)
Рассказывает про образование химической связи
Объясняет образование ковалентной связи
Записывает примеры образования ковалентной связи
Слушают учителя, записывают в тетради
Слушают, записывают
Записывают примеры образования ковалентных связей
4.Применение новых знаний (8 мин)
Предлагает составить образование ковалентных связей
Работают в тетрадях, составляют схемы образования элементов
5.Домашнее задание
(1 мин)
Объясняет выполнение домашнего задания
Записывают домашнее задание в дневники
6.Рефлексия (3 мин)
Организует рефлексию деятельности
Оценивают свою работу на уроке
План-конспект
1.Организационный момент (1 мин)
Приветствие, проверка отсутствующих и готовности класса
2. Актуализация знаний (7 мин)
2.1. Проверка домашнего задания (4 мин)
«Фронтальный опрос класса»:
1) Укажите признаки, по которым элементы объединяются в группы и периоды.
2) Как определяется радиус атома в группе и в периоде.
3) Как изменяются металлические свойства в группе.
4) Как изменяются неметаллические свойства в периоде.
5) Какой слой можно назвать завершенным.
2.2.Мотивация (3 мин)
Очень немногие элементы в природных условиях могут существовать в форме одиночных атомов. Это благородные газы – гелий He , неон Ne , аргон Ar и остальные элементы группы VIII А, простые вещества которых одноатомные молекулы.
Остальные элементы при обычных условиях существуют в виде различных простых и сложных веществ. Число атомов, входящих в состав молекул таких веществ, колеблется от двух (H 2 , O 2 , Cl 2 , HCl ) до нескольких сотен и даже тысяч.
Почему же атомам выгодно соединяться (связываться) друг с другом? Какие силы удерживают их вместе?
Атомы различных элементов в составе того или иного вещества удерживаются вместе благодаря наличию химической связи между ними.
3.Формирование новых знаний (25 мин)
3.1. Понятие химической связи (8 мин)
Химическая связь – это взаимодействие, которое связывает отдельные атомы в более сложные системы (молекулы, кристаллы и др.).
Химическая связь:
1. имеет электростатическую природу, т.е. определяется действием кулоновских сил (притяжения частиц с разноименными зарядами и отталкивания частиц с одноименными зарядами).
2. при образовании химической связи всегда должна выделяться энергия. Это является необходимым условием образования любой химической связи.
3. стремление атомов к понижению своей энергии, т.е. к достижению более устойчивого, стабильного состояния, и является основной причиной образования химической связи между двумя или более атомами.
Среди атомов различных химических элементов наиболее стабильным электронным строением обладают атомы благородных газов. У атомов He (гелия) на внешнем электронном слое находится 2е. У атомов остальных элементов VIIIA-гр.- по 8е. Следовательно, у этих атомов внешний электронный слой завершен. Это и является причиной их инертности (бездеятельности). При обычных условиях они практически не взаимодействуют с другими атомами и не образуют химических соединений. Их молекулы одноатомны.
Атомы других химических элементов стремятся приобрести электронное строение атомов ближайшего благородного газа, так как оно является наиболее стабильным.
Различают 3 типа химической связи:
Ковалентную;
Ионную;
Металлическую.
3.2. Ковалентная связь (8 мин)
Все молекулы образованы из атомов за счет ковалентной связи.
Образование молекулы водорода H 2 из отдельных атомов - один из наиболее простых примеров возникновения ковалентной связи.
При сближении атомов ядро каждого из них притягивает к себе электронное облако другого. В результате облака обоих атомов перекрываются так, что между ядрами возникает область повышенного отрицательного заряда, которую обычно наз. областью повышенной электронной плотности.
Между атомами возникает прочное взаимодействие, которое и назыв. химической связью.
Схематически образование молекулы водорода можно изобразить так:
H + H → H H
Точками на схемах при химическом знаке элемента обозначаются электроны внешнего электронного слоя, а двумя точками в формуле - пара электронов.
Обобществленная пара электронов часто показывается с помощью черточки, напр.:
H-H
Эта черточка обозначает ковалентную связь.
Ковалентная связь - это химическая связь, возникающая в результате образования общих электронных пар между двумя атомами.
Как правило, ковалентная связь возникает между атомами неметаллов.
3.3.Физминутка (2 мин)
3.4.Образование ковалентной связи (7 мин)
Рассмотрим образование более сложной молекулы хлора Cl 2 .
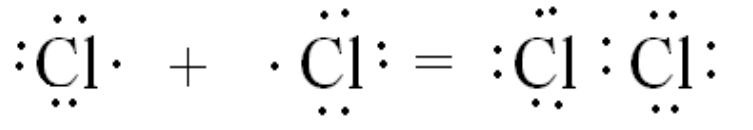
Пары электронов внешнего электронного слоя, которые не участвуют в образовании связей, также показываются на схемах с помощью черточек:
Cl -Cl
Таким образом, черточка на схемах строения молекул обозначает всегда пару электронов. Такие схемы часто называют графическими или структурными формулами. Для молекулы водорода графическая формула вам уже известна: Н-Н.
Если атомы соединены между собой с помощью одной общей электронной пары, то такая ковалентная связь называется одинарной . Но между двумя атомами может возникать и большее число связей. В таких случаях говорят о кратности связи, понимая под этим термином число электронных пар, участвующих в образовании ковалентной связи.
Два атома кислорода при образовании молекулы O 2 обобществляют уже не одну, а две пары электронов:
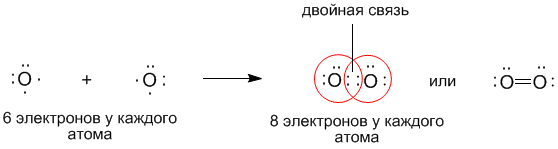
В молекуле азота N 2 атомы связаны между собой тройной ковалентной связью:
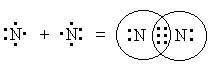
Чем больше общих электронных пар связывают два атома между собой, тем меньше расстояние между их ядрами, тем прочнее образованная молекула. Например, связь между атомами кислорода в молекуле О 2 более короткая и более прочная, чем в молекуле водорода, так как она образована одной общей электронной парой.
4.Применение новых знаний (8 мин)
1)Составьте электронные схемы образования ковалентной связи в молекулах F 2 и I 2 .
2) Составьте электронную схему образования Br 2 .
3)Какая из молекул - Cl 2 , O 2 , N 2 - более прочная?
5.Домашнее задание (1 мин)
§15, §16 упр.8.
6.Рефлексия (3 мин)
Закончите предложения:
На сегодняшнем уроке я понял, я узнал…….
На этом уроке меня порадовало……
Я похвалил бы себя……
После урока мне захотелось…..
Было трудно……
Меня удивило……
Типы химических связей. Электростатическая, ковалентная связь. Ковалентная связь в органических соединениях. Строение метана. Строение молекул с N, O-атомами с неподеленной парой электронов. Строение и физико-химические свойства органических соединений.
Связь между частицами лучше всего определять через энергию, которую система теряет при образовании соединения - аддукта.
1. Электростатическая связь
Ионная связь
Ион-дипольное взаимодействие
Диполь-дипольное взаимодействие
ИОННАЯ СВЯЗЬ
Ион-дипольное взаимодействие
Диполь-дипольное взаимодействие
2. КОВАЛЕНТНАЯ СВЯЗЬ - связь, образованная двумя электронами
Переход от ковалентной связи к ионной
Молекуляр ные орбитали - атомные орбитали
Молекула водорода Н 2
Длина связи
Энергетическая диаграмма для разрыхляющей и связывающей орбиталей
3. Структуры Льюиса
Связь между атомами обеспечивается электронными парами (американский химик Джилберт Льюис)
Некоторые свойства ковалентных связей (длина связи, по лярность связи и энергия связи)
4.1 Длина связи
Минимальное расстояние между атомами отвечает минимальной потенциальной энергии системы.
Кривая потенциальной энергии (энергетический профиль)
2 - участок притяжения, вызванного индуцированной поляризацией (дисперсионые силы Лондона).
Половина расстояния, разделяющего атомы в точке 3, соответствует вандерваальсову радиусу.
Вандерваальсовы радиусы
4.2 Полярность связи
Диоксид углерода, представляющий собой линейную молекулу, имеет нулевой дипольный момент, а дипольный момент диоксида серы, нелинейной молекулы, равен 1,6 Д.
Дипольный момент может быть рссчитан по формуле:
e-элементарный заряд
l-расстояние между центрами положительных и отрицательных зарядов.
Дипольный момент измеряют в дебаях (Д). 1 дебай равен 10-18 е·см
Средняя величина дипольных моментов связей и функциональных групп
|
Структурная единица |
Дипольный момент, Д |
|
4.3. Энергия связи
Процесс, в результате которого разрывается ковалентная связь и каждый из фрагментов сохраняет один электрон, называется «гомолизом» или «гомолитическим расщеплением».
X-Y ® X· + Y· гомолитическое расщепление
Энергия, требующаяся для гомолитического расщепления отдельной связи и образования двух нейтральных атомов, называется энергией диссоциации (ккал/моль).
Средняя величина энергии, необходимая для разрыва отдельной связи называется энергией связи.
Энергия связей, ккал/моль
Энергетический профиль образования А2
5. Связь в органических соединениях
Ковалентная связь характерна для соединений углерода, именно эта связь имеет основное значение в химии органических соединений.
Примеры написания моделей связей.
атомные орбитали углерода
Элементы пространства, в котором наиболее вероятно нахождение электрона, называют орбиталью. Орбитали отличаются формой и энергией.
6. Строение метана
Электронная конфигурация основного состояния изолированного атома углерода:
Рассмотрение электронного строения метана дает основание утверждать, что углерод 2-х валентен и должен образовывать соединения строения СН2, однако в метане углерод соединение 4 атомами углерода. Чтобы получить 4-х валентный углерод, необходимо иметь следующую схему распределения электронов:
Возбужденное состояние атома включает образование четырех новых внешних орбиталей путем «гибридизации» 2s-орбитали и всех трех 2р-орбиталей. Четыре гибридные орбитали обладают одинаковой энергией, и каждая из них обозначается 2sp3. Гибридные орбитали обладают наибольшей степенью направленности, они точно эквивалентны друг другу. Главные оси четырех гибридных орбиталей направлены к углам правильного тетраэдра - расположение, при котором орбитали максимально удалены друг от друга.
Угол связи (109,50) определяется условием максимального перекрывания гибридных орбиталей с орбиталями водорода.
Длина связи в метане 1,09 .
Энергия связи 102 ккал/моль (417,05103Дж/моль)
В отличии от ионной связи, прочность которой одинакова по всем направлениям, ковалентная связь является направленной.
Для углерода возможны три типа гибридизации:
7. Строение молекул с n, o-атомами с неподеленной парой электронов
Энергия связи 103 ккал/моль (431,24103Дж/моль)
Энергия связи 103 ккал/моль (431,24103 Дж/моль)
Наличие свободных электронов у аммиака и воды придает им основные свойства, более сильные у аммиака.
8. Строение и физико-химические свойства
Т пл., Т кип., растворимость.
Физические свойства дают информацию о строении вещества. Строение позволяет предсказать физические свойства.
Сравнить ионные и неионные соединения:
NaCl Т пл 801 0 С
СН 4 Т пл. -183 0 С
Межмолекулярные силы
Диполь-дипольное взаимодействие, вандерваальсовы силы (индуцир. диполь)
NaCl Т кип 1413 0 С (ионная пара - газообразное состояние)
CH 4 Т кип -161,5 0 С
Растворимость
Ион-дипольное взаимодействие
сольватация гидратация
Подобное растворяется в подобном. Растворимость определяется полярностью.
СН 4 и CCl 4 нерастворимы в воде
СН 3 ОН растворим в воде.
