Все вещества состоят из одинаковых частиц. Основные положения МКТ. Строение вещества. Молекула
Тема: Основы молекулярно-кинетической теории
Урок: Основные положения МКТ. Строение вещества. Молекула
Для начала давайте вспомним все предыдущие разделы физики, которые мы изучали, и поймём, что всё это время мы рассматривали процессы, происходящие с макроскопическими телами (или объектами макромира). Теперь же мы будем изучать их строение и процессы, протекающие внутри них.
Элементы водорода, кислорода, фосфора и серы образуют молекулы, состоящие из двух или более атомов одного и того же элемента. Соединения вода, углекислый газ и глюкоза состоят из комбинаций атомов разных элементов. Мы можем классифицировать материал по нескольким категориям. Две широкие категории - это смеси и чистые вещества. Чистое вещество имеет постоянный состав. Все образцы чистого вещества имеют точно такой же состав и свойства. Любой образец сахарозы состоит из 1% углерода, 5% водорода и 4% кислорода по массе.
Любой образец сахарозы также обладает такими же физическими свойствами, как температура плавления, цвет и сладость, независимо от источника, из которого он изолирован. Мы можем разделить чистые вещества на два класса: элементы и соединения. Чистые вещества, которые не могут быть разбиты на более простые вещества химическими изменениями, называются элементами. Железо, серебро, золото, алюминий, сера, кислород и медь - знакомые примеры более чем 100 известных элементов, из которых около 90 встречаются естественным образом на земле, и в лаборатории созданы две дюжины или около того.
Определение. Макроскопическое тело - тело, состоящее из большого числа частиц. Например: машина, человек, планета, бильярдный шар…
Микроскопическое тело - тело, состоящее из одной или нескольких частиц. Например: атом, молекула, электрон… (рис. 1)

Чистые вещества, которые могут быть разрушены химическими изменениями, называются соединениями. Эта разбивка может приводить к образованию элементов или других соединений или того и другого. Хлорид серебра - это белое твердое вещество, которое может быть разбито на его элементы, серебро и хлор, поглощением света. Это свойство является основой для использования этого соединения в фотографических пленках и фотохромных очках.
Составный оксид ртути при нагревании разлагается на серебристые капли жидкой ртути и невидимого газообразного кислорода. Рисунок В зависимости от его свойств данное вещество может быть классифицировано как гомогенная смесь, гетерогенная смесь, соединение или элемент.
Рис. 1. Примеры микро- и макрообъектов соответственно
Определив таким образом предмет изучения курса МКТ, следует теперь поговорить об основных целях, которые ставит перед собой курс МКТ, а именно:
- Изучение процессов, происходящих внутри макроскопического тела (движение и взаимодействие частиц)
- Свойства тел (плотность, масса, давление (для газов)…)
- Изучение тепловых явлений (нагревание-охлаждение, изменения агрегатных состояний тела)
Изучение этих вопросов, которое будет проходить на протяжении всей темы, начнётся сейчас с того, что мы сформулируем так называемые основные положения МКТ, то есть некоторые утверждения, истинность которых уже давно не подвергается сомнениям, и, отталкиваясь от которых, будет строиться весь дальнейший курс.
Кислород составляет почти половину и кремний около четверти от общего количества этих элементов. Большинство элементов на Земле находятся в химических комбинациях с другими элементами; около четверти элементов также находятся в свободном состоянии. Вода состоит из элементов водорода и кислорода, объединенных в соотношении 2 к 1. Вода может быть разбита на водород и кислородные газы путем добавления энергии.
Рисунок Разложение воды показано на макроскопическом, микроскопическом и символическом уровнях. Батарея обеспечивает электрический ток, который разлагает воду. На макроскопическом уровне жидкость отделяется от газов водорода и кислорода. Распад воды включает перегруппировку атомов в молекулах воды в разные молекулы, каждая из которых состоит из двух атомов водорода и двух атомов кислорода соответственно. Две молекулы воды образуют одну молекулу кислорода и две молекулы водорода. Представление о том, что происходит, будет рассмотрено более подробно в последующих главах.
Разберём их по очереди:
Все вещества состоят из большого количества частиц - молекул и атомов.
Определение. Атом - мельчайшая частица химического элемента. Размеры атомов (их диаметр) имеет порядок см. Стоит отметить, что различных типов атомов, в отличие от молекул, относительно немного. Все их разновидности, которые на сегодняшний день известны человеку, собраны в так называемой таблице Менделеева (см. рис. 2)
Полученные два газа имеют совершенно разные свойства. Кислород не горюч, но необходим для сжигания топлива, а водород является легковоспламеняющимся и мощным источником энергии. Одно из применений включает исследования в более экономичную транспортировку.
Они более эффективны, чем транспортные средства с двигателями внутреннего сгорания, не загрязняют окружающую среду и сокращают выбросы парниковых газов, что делает нас менее зависимыми от ископаемого топлива. Топливный элемент генерирует электрическую энергию из водорода и кислорода через электрохимический процесс и производит только воду в качестве отработанного продукта. Сотовые телефоны изготовлены из многочисленных химических веществ, которые извлекаются, очищаются, очищаются и собираются с использованием обширного и глубокого понимания химических принципов.
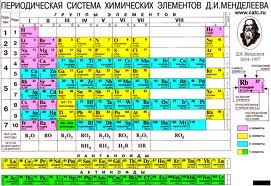
Рис. 2. Периодическая таблица химических элементов (по сути разновидностей атомов) Д. И. Менделеева
Молекула - структурная единица вещества, состоящая из атомов. В отличие от атомов, они больше и тяжелее последних, а главное, они обладают огромным разнообразием.
Около 30% элементов, которые находятся в природе, находятся в типичном смартфоне. Экран дисплея выполнен из специально закаленного стекла и покрыт материалом, чтобы сделать его проводящим. На печатной плате используется полупроводниковый материал; обычно используемые металлы, такие как медь, олово, серебро и золото; и более незнакомые элементы, такие как иттрий, празеодим и гадолиний. Батарея опирается на ионы лития и множество других материалов, включая железо, кобальт, медь, полиэтиленоксид и полиакрилонитрил.
Рисунок Почти одна треть естественных элементов используется для создания сотового телефона. Материя - это все, что занимает пространство и имеет массу. Основным строительным блоком материи является атом, наименьшая единица элемента, которая может входить в комбинации с атомами того же или других элементов. Во многих веществах атомы объединяются в молекулы. На земле вещество обычно существует в трех состояниях: твердые тела, фиксированной формы и объема; жидкости с переменной формой, но с фиксированным объемом; и газов переменной формы и объема.
Вещество, молекулы которого состоят из одного атома, называются атомарными , из большего количества - молекулярными . Например: кислород, вода, поваренная соль () - молекулярные; гелий серебро (He, Ag) - атомарные.
Причём следует понимать, что свойства макроскопических тел будут зависеть не только от количественной характеристики их микроскопического состава, но и от качественной.
В высокотемпературных условиях вещество также может существовать как плазма. Большая часть вещества представляет собой смесь: она состоит из двух или более типов веществ, которые могут присутствовать в разных количествах и могут быть разделены физическими средствами. Гетерогенные смеси различаются по составу от точки к точке; однородные смеси имеют один и тот же состав от точки к точке. Чистые вещества состоят только из одного типа вещества. Чистым веществом может быть элемент, который состоит только из одного типа атома и не может быть разрушен химическим изменением или соединением, состоящим из двух или более типов атомов.
 |
Если в строении атомов вещество имеет какую-то определённую геометрию (кристаллическую решётку ), или же, наоборот, не имеет, то этим телам будут присущи различные свойства. Например, аморфные тела не имеют строгой температуры плавления. Самый известный пример - это аморфный графит и кристаллический алмаз. Оба вещества состоят из атомов углерода.
Химия Конец главы Упражнения
Ответы для химии Конец главы Упражнения. Жидкости могут менять свою форму; твердые тела не могут. Газы могут претерпевать большие изменения объема при изменении давления; жидкостей нет. Объем и расход газов; твердых веществ нет. Смесь может иметь множество композиций; чистое вещество имеет определенный состав. Оба имеют один и тот же состав от точки к точке.
Молекулы элементов содержат только один тип атома; молекулы соединений содержат два или более типов атомов. Они аналогичны тем, что оба они состоят из двух или более атомов, химически связанных друг с другом. Элемент; элемент; соединение; смесь, соединение; соединение; соединение; смесь.


Рис. 3. Графит и алмаз соответственно
Таким образом «из скольких, в каком взаимном расположении и каких атомов и молекул состоит вещество?» - первый вопрос, ответ на который приблизит нас к пониманию свойств тел.
В каждом случае молекула состоит из двух или более объединенных атомов. Они отличаются тем, что типы атомов меняются от одного вещества к другому. Бензин, кислород и, в меньшей степени, потребляются азотом. Двуокись углерода и вода являются основными продуктами. Оксиды углерода и оксиды азота производятся в меньших количествах.
Как мы знаем, что существуют Атомы? Сначала атомы считались наименьшим элементом материи. Что произойдет, если вы что-нибудь возьмете и порежьте пополам, а потом порежьте пополам и продолжаете идти? Первоначальная концепция атома вытекает из предполагаемого результата этого мысленного эксперимента. В конце концов вы оказались с чем-то, что не может быть разрезано.
Все упомянутые выше частицы находятся в непрерывном тепловом хаотическом движении.
Так же, как и в рассматриваемых выше примерах, важно понимание не только количественных аспектов этого движения, но и качественных для различных веществ.
Молекулы и атомы твёрдых тел совершают лишь небольшие колебания относительно своего постоянного положения; жидких - также совершают колебания, но из-за больших размеров межмолекулярного пространства иногда меняются местами друг с другом; частички газа, в свою очередь, практически не сталкиваясь, свободно перемещаются в пространстве.
Конечно, превратить этот мысленный эксперимент в реальный не практично, поэтому существование атомов обсуждалось на протяжении веков. Систематическое изучение химии позволило Дж. Далтону сформулировать современную теорию атомов. Он основан на наблюдении, что различные материалы реагируют друг с другом в фиксированных массовых соотношениях. Например, если вы химически объединяете водород и кислород для образования воды, вы всегда обнаружите, что масса используемого кислорода в 8 раз превышает массу водорода.
Было обнаружено, что все химические реакции ведут себя таким образом. Таким образом, все известные химические вещества, созданные из молекул, могут быть построены из гораздо меньшего числа атомов. Если бы материя состояла из крошечных частиц, которые бы только объединялись определенным образом, то это то, что должно быть.
Частицы взаимодействуют друг с другом.
Взаимодействие это носит электромагнитный характер (взаимодействия ядер и электронов атома) и действует в обе стороны (как притягивание, так и отталкивание).

Здесь: d - расстояние между частицами; a - размеры частиц (диаметр).
Но это не исключает других возможностей. Те же экспериментальные результаты также будут найдены, если бы была какая-то особенность в том, как работа химии заставила это поведение. Так какие еще доказательства существуют? Изучение газов показало, что существует связь между температурой, массой, объемом и давлением всех газов. В кинетической теории газов говорится, что газы состоят из одинаковых частиц, движущихся с высокой скоростью, и они отскакивают друг от друга и стенки их контейнера. Откат этих отскоков является источником давления, а скорость определяется массой и температурой.
Впервые понятие «атом» было введено древнегреческим философом и естествоведом Демокритом (рис. 4). В более поздний период активно задался вопросом о структуре микромира русский учёный Ломоносов (рис. 5).

Рис. 4. Демокрит

Из этих предположений можно предсказать поведение газов. Итак, здесь мы имеем другое, очень различное явление, которое объясняется предположениями, что материя состоит из крошечных бит. Этого было достаточно для большинства людей, но не для всех. Они думали, что атомы и молекулы являются просто удобной фикцией, которая помогла получить правильный ответ, но не имела физической реальности. Это не так глупо, как могло бы звучать. Такие удобные фикции действительно существуют. Примером этого могут служить магнитные силовые линии.
Магнитные силы действуют по этим линиям, и они являются удобным способом вычисления многих эффектов в электромагнетизме, но они не фактически существуют. Клинчер пришел от известного человека, но большинство людей с удивлением узнали, что это Альберт Эйнштейн. Его статья не только предсказывала, как должно выглядеть движение, но и позволяет вычислять массу одной молекулы. В этот момент ни один ученый серьезно не сомневался в существовании атомов. Было слишком много различных явлений, которые были объяснены атомной теорией как качественно, так и количественно.
Рис. 5. Ломоносов
На следующем занятии мы введём методы качественного обоснования основным положениям МКТ.
Список литературы
- Мякишев Г.Я., Синяков А.З. Молекулярная физика. Термодинамика. - М.: Дрофа, 2010.
- Генденштейн Л.Э., Дик Ю.И. Физика 10 класс. - М.: Илекса, 2005.
- Касьянов В.А. Физика 10 класс. - М.: Дрофа, 2010.
- Elementy.ru ().
- Samlib.ru ().
- Youtube ().
Домашнее задание
Но теперь у нас есть еще больше доказательств. Квантово-механическое описание атомов предсказывает с удивительной точностью детали атомных спектров. Отдельные ионы можно манипулировать электрическими и магнитными полями. Существуют даже карты высот поверхностей, которые показывают удары, вызванные отдельными атомами.
Химия - это наука, а также школьный предмет. Слово происходит от древнего египетского языка и означает «черная земля». Химия касается того, какие вещества существуют и какие качества у них есть. Еще одна задача химиков - найти новые вещества, обладающие особыми свойствами.
- *Благодаря какой силе возможно сделать эксперимент по измерению размеров молекулы масла, показанный в видеоуроке?
- Почему молекулярно-кинетическая теория не рассматривает органические соединения?
- Почему даже очень маленькая песчинка песка является объектом макромира?
- Силы преимущественно какой природы действуют на частицы со стороны других частиц?
- Как определить, является ли некая химическая структура химическим элементом?
СТРОЕНИЕ ВЕЩЕСТВА
Что вы делаете в химии?
Но химик должен знать атомы. Ему нужно знать, как они себя ведут, когда они встречаются друг с другом и как они держатся вместе. Но понять, что вы не видите, нелегко. Поэтому дети занимаются химией только в классах высшей школы. Химия доступна в качестве школьного предмета в Германии, как правило, только из класса или даже позже. Это зависит от состояния, в котором находится школа. В химии вы экспериментируете между прочим. Он использует специальное оборудование и химические вещества, выбранные учителем химии.
Тем не менее, ученикам не разрешают делать все эксперименты, которые они хотят делать. Потому что это может быть очень опасно. Учитель химии знаком с этим, потому что он изучал химию в университете. Вот почему он объясняет студентам, что именно нужно делать и что нужно искать в безопасности.
Все вещества состоят из отдельных мельчайших частиц: молекул и атомов.
Основоположником идеи дискретного строения вещества (т.е. состоящего из отдельных частиц) считается древнегреческий философ Демокрит, живший около 470 года до новой эры. Демокрит считал, что все тела состоят из бесчисленного количества сверхмалых, невидимых глазу, неделимых частиц. "Они бесконечно разнообразны, имеют впадины и выпуклости, которыми сцепляются, образуя все материальные тела, а в природе существуют только атомы и пустота.
Догадка Демокрита была надолго забыта. Однако, его взгляды на строение вещества дошли до нас благодаря римскому поэту Лукрецию Кару: "... все вещи, как мы замечаем, становятся меньше, И как бы тают они в течение долгого века..."
Атомы.
Атомы очень малы. Их невозможно разглядеть не только простым глазом, но и с помощью даже самого мощного оптического микроскопа.
Глаз человека не способен разглядеть атомы и промежутки между ними, поэтому любое вещество кажется нам сплошным.
В 1951 году Эрвин Мюллер изобрёл ионный микроскоп, позволивший в деталях разглядеть атомную структуру металла.
Атомы различных химических элементов отличаются друг от друга. Различия атомов элементов можно определить по периодической таблице Менделеева.
Молекулы.
Молекула - это мельчайшая частица вещества, обладающая свойствами этого вещества. Так, молекула сахара - сладкая, а соли - соленая.
Молекулы состоят из атомов.
Размеры молекул ничтожно малы.
Как увидеть молекулу? - с помощью электронного микроскопа.

Как добыть молекулу из вещества? - механическим дроблением вещества. Каждому веществу соответствует определеенный вид молекул. У разных веществ молекулы могут состоять из одного атома (инертные газы) или из нескольких одинаковых или различных атомов, или даже из сотен тысяч атомов (полимеры). Молекулы различных веществ могут иметь форму треугольника, пирамиды и других геометрических фигур, а также быть линейными.
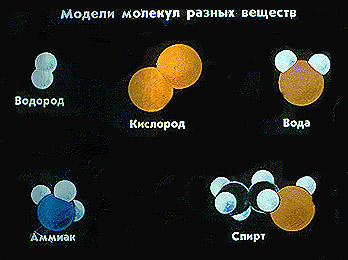
Молекулы одного и того же вещества во всех агрегатных состояниях одинаковы.

Между молекулами в веществе существуют промежутки. Доказательствами существования промежутков служат изменение объема вещества, т.е. расширение и сжатие вещества при изменении температуры
Домашняя работа.
Задание. Ответить на вопросы:
№ 1.
1. Из чего состоят вещества?
2. Какие опыты подтверждают, что ве¬щества состоят из мельчайших частиц?
3. Как меняется объём тела при изменении расстояния между частицами?
4. Какой опыт пока¬зывает, что частицы вещества очень малы?
5. Что такое молекула?
6. Что вы знаете о размерах молекул?
7. Из каких частиц состоит молекула воды?
8. Как изображается схемати¬чески молекула воды?
№ 2.
1. Одинаков ли состав молекул воды в горячем чае и в охлаждённом напитке «Кола»?
2. Почему изнашиваются подмётки у ботинок и стираются до дыр локти пиджаков?
3. Как объяснить высыхание лака на ногтях?
4. Вы проходите мимо пекарни. Из нее доносится аппетитный запах свежего хлеба…. Как это могло произойти?
Опыт Роберта Рэлея.
Размеры молекул были определены во многих опытах. Один из них провел английский ученый Роберт Рэлей.
В чистый широкий сосуд налили воду и на ее поверхность поместили каплю оливкового масла. Капля растеклась по поверхности воды и образовала круглую пленку. Постепенно площадь пленки увеличивалась, но затем растекание прекратилось и площадь перестала изменяться. Релей предположил, что молекулы расположились в один ряд, т.е. толщина пленки стала равна как раз размеру одной молекулы, и решил определить ее толщину. При этом, конечно, нужно учесть, что объем пленки равен объему капли.
По тем данным, которые были получены в опыте Рэлея, рассчитаем толщину пленки и узнаем, чему равен линейный размер молекулы масла. Капля имела объем 0,0009 см3, а площадь пленки, образовавшейся из капли, была равна 5500 см2. Отсюда толщина пленки:
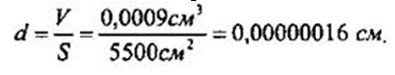
Экспериментальное задание:
Проделать в домашних условиях опыт по определению размеров молекул масла.
Для опыта удобно воспользоваться чистым машинным маслом. Сначала определите объем одной капли масла. Придумайте сами, как это сделать при помощи пипетки и мензурки (можно воспользоваться мензуркой, которой отмеривают лекарства).
Налейте в тарелку воды и на ее поверхность поместите каплю масла. Когда капля растечется, измерьте диаметр пленки линейкой, положив ее на края тарелки. Если поверхность пленки не будет иметь форму круга, то или подождите, когда она примет такую форму, или сделайте несколько измерений и определите ее средний диаметр. Затем вычислите площадь пленки и ее толщину.
Какое число вы получили? Во сколько раз оно отличается от действительных размеров молекулы масла?
